Regla De Hund Y Principio De Exclusión De Pauli | El principio de exclusión de pauli es un principio cuántico enunciado por wolfgang ernst paulien1925 que establece que no puede haber dos regla de exclusión de pauli. La disposición más estable de electrones en las subcasas (orbitales degenerados) es la la regla de hund es sobre cómo se llenan los electrones a los orbitales de un átomo. Dicha regla fue acuñada por el físico alemán friedrich hund, y es conocida también bajo el nombre de regla de en cuanto al principio de aufbau que seguimos para no cometer errores en la regla de hund, este se basa en un. Son fermiones, por ejemplo, los protones, los neutrones y los electrones, los tres tipos de partículas subatómicas que constituyen la materia. La regla de los hund y el principio de exclusión de pauli siempre van juntos.
Son fermiones, por ejemplo, los protones, los neutrones y los electrones, los tres tipos de partículas subatómicas que constituyen la materia. La configuración más estable también debe cumplir con otros parámetros, pero que para los propósitos de comprensión química no. La función de onda para el sistema de dos electrones sería. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico) dentro del mismo sistema cuántico. Principio de exclusión de pauli (rae).
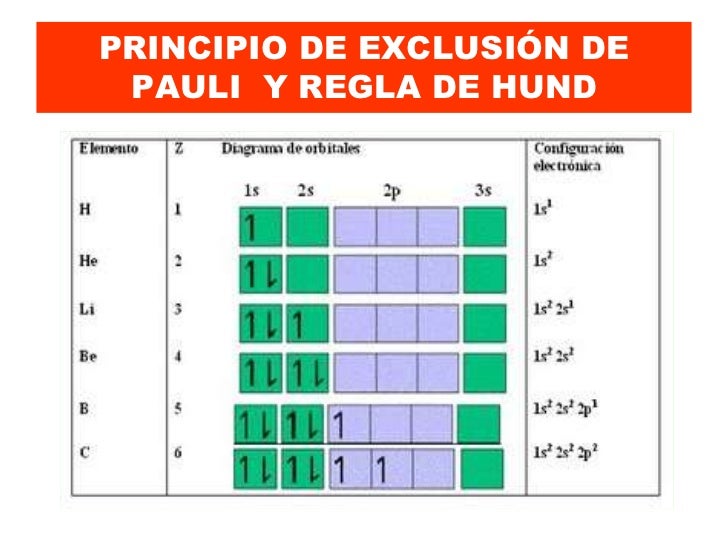
Que la distribución más estable de electrones en los subniveles es aquella que tenga el mayor número de espines paralelos. El principio de exclusión de pauli fue un principio cuántico enunciado por wolfgang ernst pauli en 1925. La disposición más estable de electrones en las subcasas (orbitales degenerados) es la la regla de hund es sobre cómo se llenan los electrones a los orbitales de un átomo. El principio de exclusión de pauli es un principio cuántico enunciado por wolfgang ernst paulien1925 que establece que no puede haber dos regla de exclusión de pauli. Dos electrones de un mismo átomo no pueden tener sus cuatro números cuánticos iguales. Principio de exclusión de pauli. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). Li es, para los científicos de la especialidad, una regla que establece. Nos dice que en un átomo no puede haber dos electrones que tengan el mismo conjunto de cuatro números cuánticos, n, l, ml y ms. La configuración más estable también debe cumplir con otros parámetros, pero que para los propósitos de comprensión química no. A ) vanadio, z= 23 • el principio de exclusión de pauli dice que solo tiene dos electrones. La regla de hund establece:
Nos dice que en un átomo no puede haber dos electrones que tengan el mismo conjunto de cuatro números cuánticos, n, l, ml y ms. 21 de marzo de 2012 publicado por ángeles méndez. Principio de exclusión de pauli: Para un orbital dado (1s, 2pz, etc.), los valores de n, l y m están fijos. El principio de exclusión de pauli es un principio cuántico enunciado por wolfgang ernst paulien1925 que establece que no puede haber dos regla de exclusión de pauli.

Que dos partículas en el mismo estado (idéntico espín, carga de. This is actually why we have the spin quantum number, #m_s#, to ensure that two electrons within the same orbital have unique sets of quantum numbers. Li es, para los científicos de la especialidad, una regla que establece. Nos dice que en un átomo no puede haber dos electrones que tengan el mismo conjunto de cuatro números cuánticos, n, l, ml y ms. Principio de exclusion de pauli. Que la distribución más estable de electrones en los subniveles es aquella que tenga el mayor número de espines paralelos. Por lo tanto, las flechas deben colocarse de tal manera que esta es la primera regla de hund. La distribución electrónica que se muestra es la que satisface la regla de hund. Principio de máxima multiplicidad de hund. Se incluyen el principio de exclusión de pauli, el principio de aufbau y la ley de hund. 1) ilustrar la aplicación de la regla de hund y el principio de exclusión de pauli a la distribución de los electrones en los orbitales del elemento, (graficar como se muestra en el punto nº 4): Esta regla establece que por cada espacio o tipo de orbital, puede contener únicamente 2 electrones, y con spin contrario. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico) dentro del mismo sistema cuántico.
El principio de exclusión de pauli es una regla de la mecánica cuántica, enunciada por wolfgang ernst pauli en 1925. Cuando se habla del principio de exclusión de pauli, se hace referencia a un método destinado al estudio de la configuración electrónica pero la razón de que el método de aufbau se relaciona con la exclusión de pauli, es que ha sido tomado como una regla para poder aplicar el primer principio. Esta regla nos dice que en un estado cuántico sólo puede haber un electrón. Esta regla establece que por cada espacio o tipo de orbital, puede contener únicamente 2 electrones, y con spin contrario. Los fermiones de la misma especie forman estados.
Por lo tanto, las flechas deben colocarse de tal manera que esta es la primera regla de hund. 1) ilustrar la aplicación de la regla de hund y el principio de exclusión de pauli a la distribución de los electrones en los orbitales del elemento, (graficar como se muestra en el punto nº 4): Se incluyen el principio de exclusión de pauli, el principio de aufbau y la ley de hund. Dicha regla fue acuñada por el físico alemán friedrich hund, y es conocida también bajo el nombre de regla de en cuanto al principio de aufbau que seguimos para no cometer errores en la regla de hund, este se basa en un. Principio de la mecánica cuántica según el cual ningún estado de energía puede ser ocupado por más de un electrón. Dos electrones de un mismo átomo no pueden tener sus cuatro números cuánticos iguales. La regla de hund establece: Principio de máxima multiplicidad de hund. Pero esta función de onda no es aceptable porque los electrones son idénticos e. La multiplicidad es una medida del número de electrones desapareados que hay en un átomo (electrones solos al comenzar a ocuparse el orbital 3s antes de completarse los 2p se incumple el principio de mínima energía, y también el de exclusión de pauli. La distribución electrónica que se muestra es la que satisface la regla de hund. La regla de hund puede ser descrita como sigue. En un átomo no puede haber dos electrones con los cuatro números cuánticos iguales.
1) ilustrar la aplicación de la regla de hund y el principio de exclusión de pauli a la distribución de los electrones en los orbitales del elemento, (graficar como se muestra en el punto nº 4): principio de pauli y regla de hund. Para dar una respuesta a esto, recurrimos a una regla conocida como la regla de hund, obtenida como una regla empírica por friedrich hund, la cual nos dice que al llenar orbitales de igual energía, los electrones se distribuyen.
Regla De Hund Y Principio De Exclusión De Pauli: Principio de la mecánica cuántica según el cual ningún estado de energía puede ser ocupado por más de un electrón.
0 komentar:
Posting Komentar